报告限、忽略限、检测限、定量限、积分限
有的说检测限以下不用积分,有的说按照原USP 忽略限的一半是积分限,甚至有的说报告限以下不用积分。报告限、积分限、检测限、忽略限、定量限,这几个概念夹杂在一起很容易混淆,到底如何来理解。检测限、定量限、报告限在ICH Q3A/B中比较统一,故比较清晰。
对于报告限、忽略限自2016年以来FDA和USP相关人员经历了好几轮讨论,在USP<621>修订草案意见时,FDA/EP/JP等各机构都参与了讨论。考虑各产品报告限不同可能导致较小毒性杂质漏检,2016年FDA建议在USP药典各论中取消报告限,要基于最大日剂量MDD来考虑。

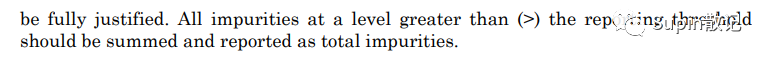

USP2023 <621>,<476>,<1086>:超过该限度需要报告具体数值,一般为0.05%;大于报告限的杂质应相加计算作为“总杂质”



EP 11.0<2.2.46>:同USP<621>,根据ICH 药典统一原则

EDQM FAQs:报告限同忽略限,低于报告限不计入总杂质计算
How can I determine the total impurities? Which peaks can be disregarded?

关于USP<621>报告限修订,USP和FDA、EDQM都经过了不断地讨论,并综合了各企业意见,才最终定下USP 2023如上述修改。


原USP<621>/EP2.2.46均有如下图一段话:


当前USP 621已删除积分设置这段话:积分设置至少是忽略限的一半
虽然这段话已删除,但风险考虑是一致的。积分设置与报告限之间要有个限度空间,以保证报告限结果的准确性。
积分设置:可以检测限设置积分;如果定量限远小于报告限(10倍以上),可以设置报告限的一半作为积分参数
报告限及以上杂质,是具有临床意义,是从日最大摄入量的安全性来考虑,所以这些杂质含量结果是要能够被准确定量的。报告限及以上杂质要计入总杂质计算。
积分设置要低于报告限,以便于能够追溯杂质的变化趋势。