全氟烷基膦酸诱导鲤鱼性别和化学特异性肝毒性的机制

题目:Underlying Mechanisms for the Sex- and Chemical-Specific Hepatotoxicity of Perfluoroalkyl Phosphinic Acids in Common Carp (Cyprinus carpio)
摘 要
全氟烷基和多氟烷基物质(PFASs)的肝毒性已被广泛研究,但对其性别的特异性差异却知之甚少。本研究采用不同性别的鲤鱼,来揭示新兴全氟烷基膦酸(6:6和8:8 PFPiAs)的性别特异性肝毒性。雄性和雌性鲤鱼肝脏中均观察到明显的肝毒性,包括细胞坏死、凋亡和脂肪变性。肝脏脂质代谢失调(脂质过度蓄积)是肝细胞脂肪变性的主要原因,但其机制具有性别差异,对雌性表现为抑制肝脏中脂肪酸(FAs)的氧化分解,雄性表现为增强肝脏对FAs的摄取。利用非靶向脂质组学验证了这两种化合物对FA、鞘脂、甘油脂和甘油磷脂代谢途径的破坏,从而导致氧化应激的产生。此外,促炎细胞因子表达增加和抗炎细胞因子表达抑制,表明产生的氧化应激进一步发展成炎症。相较雌鱼,雄鱼更易受到PFPiA的干扰。虽然8:8 PFPiA在鱼体的蓄积比6:6 PFPiA更少,但引起了更强的肝毒性,这可能是由于其与介导脂质代谢和炎症核转录因子的结合能力更强。这项研究强调了PFASs在生物体内的生物累积和毒性与性别和化学物质相关。
研究背景
全氟烷基膦酸(Perfluoroalkyl phosphinic acids,PFPiA)是广泛用于家用清洁产品中的一类新型全氟烷基和多氟烷基物质(PFASs),在地表水、沉积物、室内灰尘、生物体和人体血液中被广泛检测到,其中6:6、6:8和8:8 PFPiAs是最常检测到的物质。与传统PFAS类似,6:6和8:8的PFPiAs主要在鲤鱼肝脏中积累并诱导肝毒性。但是与传统PFAS相比,PFPiA具有更大的碳骨架和不同的官能团,基于传统PFAS的结果预测PFPiA诱导的肝毒性存在很大的不确定性。因此PFPiAs的结构与其毒性作用的关系需要被研究。其次,在各种物种中都发现了PFASs的性别特异性毒性,但很少有人解释其潜在机制。此外,还应考虑到复杂的生物过程之间的相互作用,如果只针对一种特定的生物途径,这些相互作用可能会被误解。因此,应用非靶向组学来鉴定潜在的生物标志物并证明它们之间的关联非常重要。本文以鲤鱼为模型生物,研究了6:6和8:8PFPiAs的性别特异性肝毒性。研究目的是(1)表征PFPiA诱导的鲤鱼肝毒性;(2)揭示PFPiA诱导鲤鱼肝毒性的分子机制与化学结构和浓度的关系;(3)阐明PFPiA诱导鲤鱼肝毒性的性别差异及机制。
主要发现
PFPiA暴露后鲤鱼的肝细胞出现剂量依赖性凋亡、坏死和胞浆空泡化等微结构损伤(图1)。雄性肝细胞的微结构损伤均大于雌性,这与PFPiAs在雄性肝脏中的累积浓度高于雌性肝脏相一致。尽管8:8PFPiA的蓄积少于6:6PFPiA,但8:8PFPiA对肝细胞的超微结构损伤比6:6PFPiA更明显,说明8:8PFPiA具有更强的肝毒性。
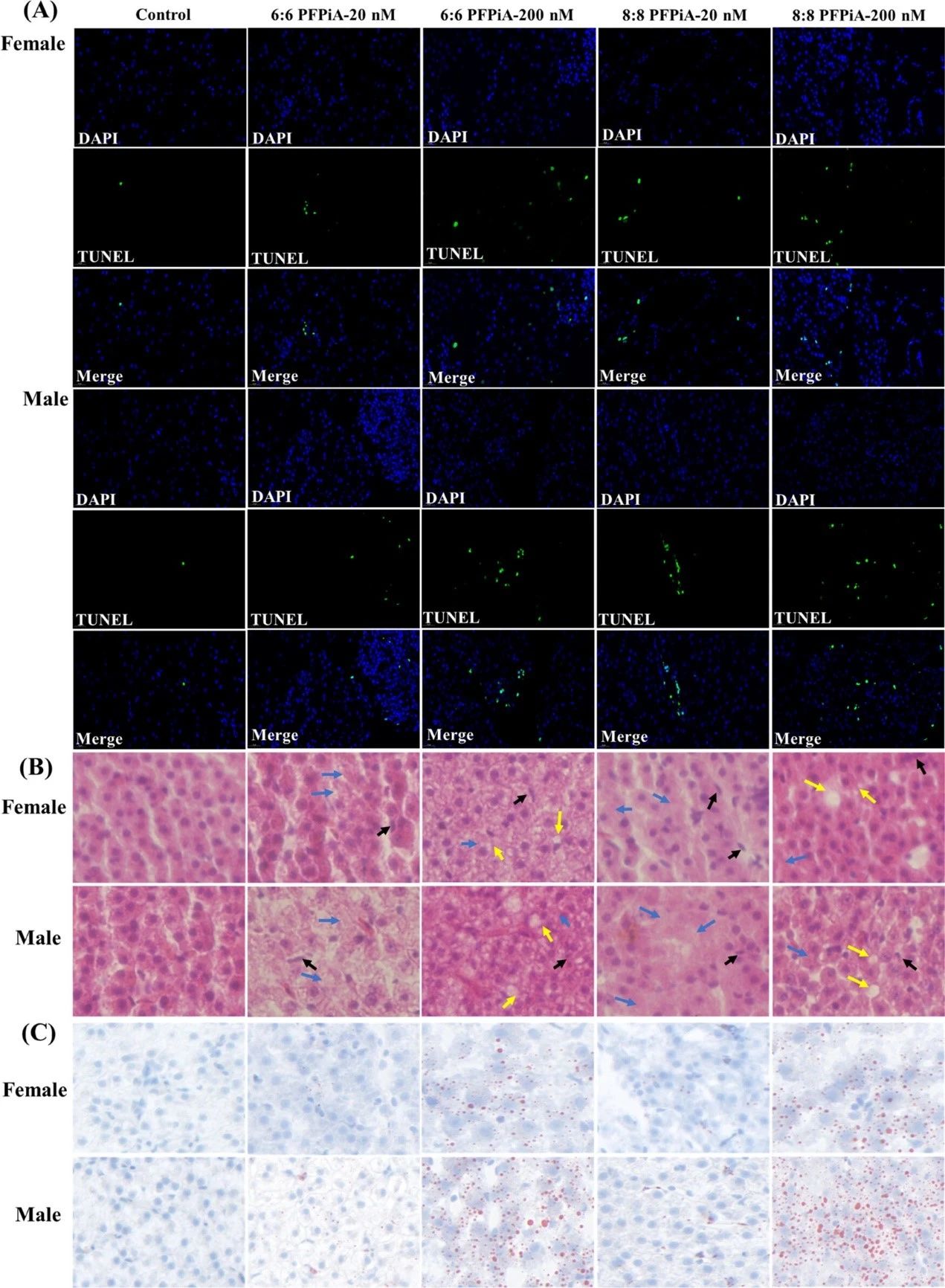
图1 TUNEL染色(A)、苏木精和伊红(H&E)染色(B),油红O染色(C)的肝脏图片。蓝色、黑色和黄色箭头分别表示核溶解、核固缩和核空泡化;红点表示脂滴。
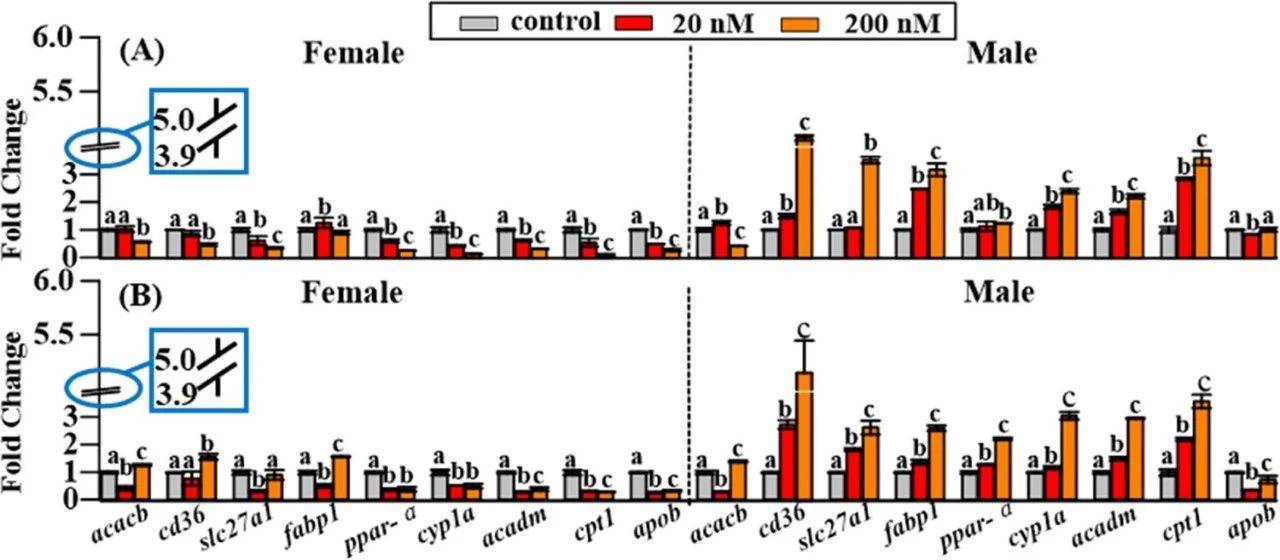
图2 6:6 PFPiA(A)和8:8 PFPiA(B)暴露后雌性和雄性肝脏脂质代谢相关基因表达变化。
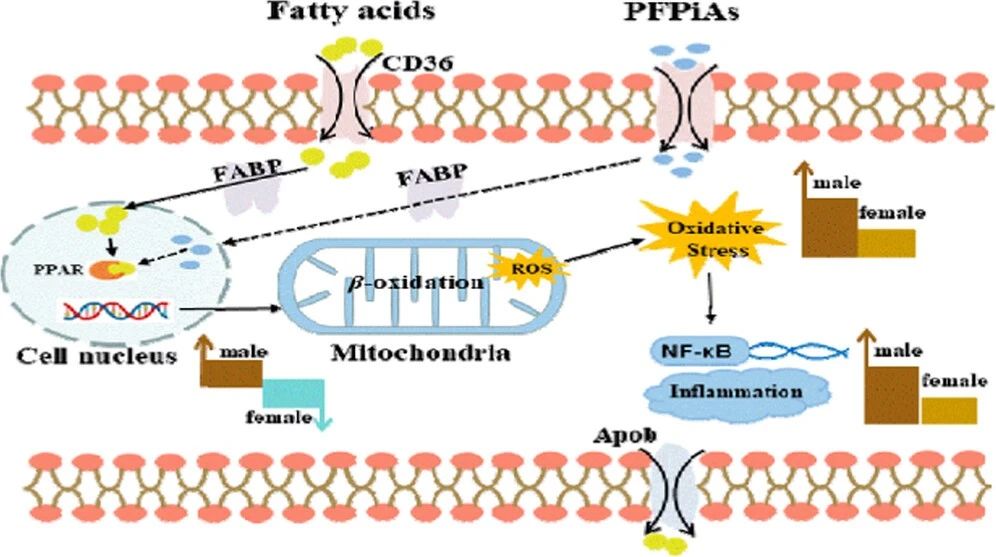
雄性和雌性肝脏中变化最显著的脂质代谢产物主要是脂肪酸、甘油脂、甘油磷脂、鞘脂和甾醇脂,它们涉及三条代谢途径,包括脂肪酸代谢、鞘脂代谢、甘油脂和甘油磷脂代谢,并且雌、雄鲤鱼的脂肪代谢存在显著差异,表明脂肪代谢也具有性别特异性。在脂肪酸代谢途径中,乙酰-卡尼汀(ACar)在雄性肝脏中明显升高,但在雌性肝脏中下降。ACar的产生增加可以促进长链和中链脂肪酸进入线粒体进行随后的β氧化,而在女性肝脏中,ACar的不足会抑制这一过程(图3)。这一发现进一步支持了编码脂肪酸β-氧化基因的性别特异性表达,说明PFPiA诱导鲤鱼肝毒性的性别差异。
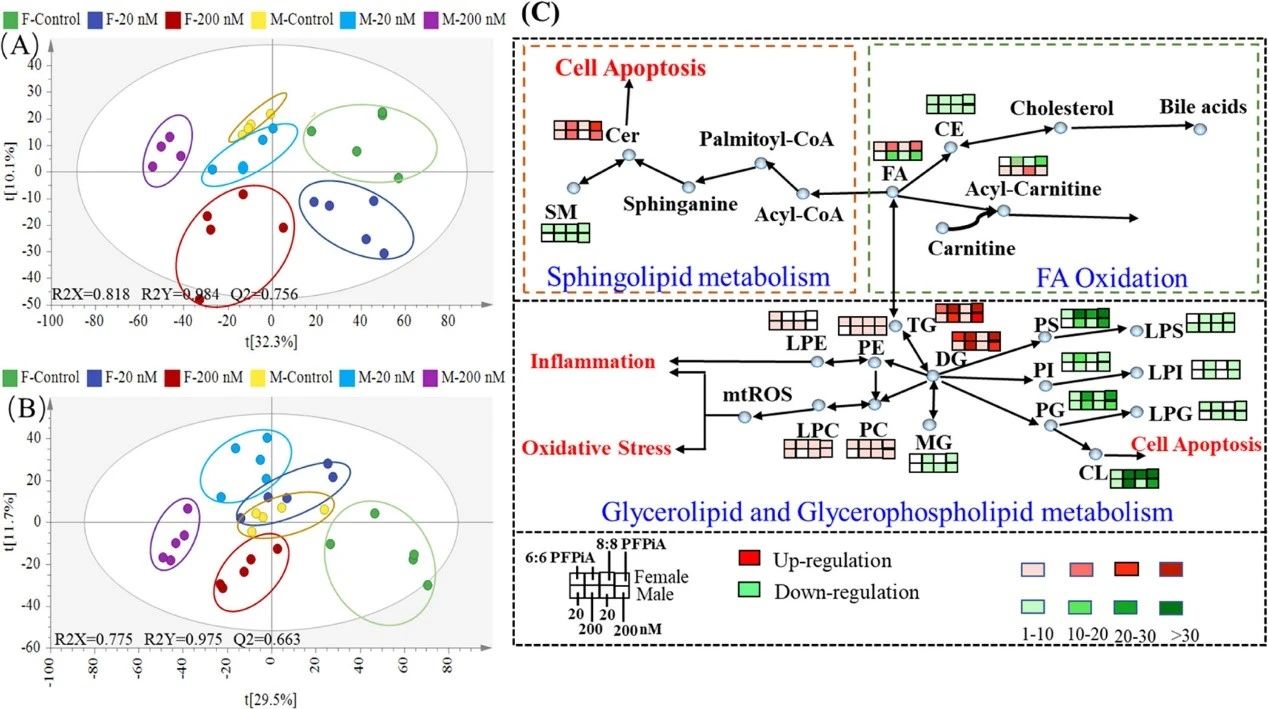
图3 6:6和8:8 PFPiAs诱导的雌性和雄性肝脏中的脂质代谢物变化。
原文链接:
https://doi.org/10.1021/acs.est.3c04964
说明:本推送只用于学术交流,如有侵权,请联系删除。
投稿&合作请联系:ecs_pku@163.com
<
专题:PFAS:
- 01. Nature深度分析|欧盟禁令提案的辩论—全世界能摆脱PFAS吗?
- 02. 法国土地应用的生物固体、堆肥和其他有机废弃物中PFAS的靶向与非靶向筛查
- 03. 韩国沿海水域鲸类体内极性和中等极性AhR激动剂的识别:效应导向分析和全扫描筛查
- 04. 加拿大机场受污染土壤和地下水中的全氟化合物
- 05. 受水成膜泡沫(AFFF)污染地区牛体内的新型PFAS
- 06. 德国PFAS污染土壤场地:直接TOP测定法氧化前后基于Kendrick质量缺陷和FindPFΔS的非靶向筛查
- 07. 全氟和多氟烷基物质(PFAS)总量的综合测定方法
- 08. 如何应对PFAS管控?
- 09. 加州大学河滨分校刘晋勇团队EST:水合电子对全氟烷基和多氟烷基物质(PFAS)的脱氟作用:结构依赖性及对PFAS修复和管理的启示
- 10. 医学科普/四、PFAS是什么?与我们的生活有关吗?
- 11. 全氟烷基膦酸诱导鲤鱼性别和化学特异性肝毒性的机制
- 12. 美国PFAS去除技术
- 13. 这种化学品,缺料危机至今无解
- 14. 新技术!有效实现PFAS的100%脱氟效果
- 15. 天津污水处理厂新型全氟和多氟烷基化合物的非靶向筛查和归趋研究